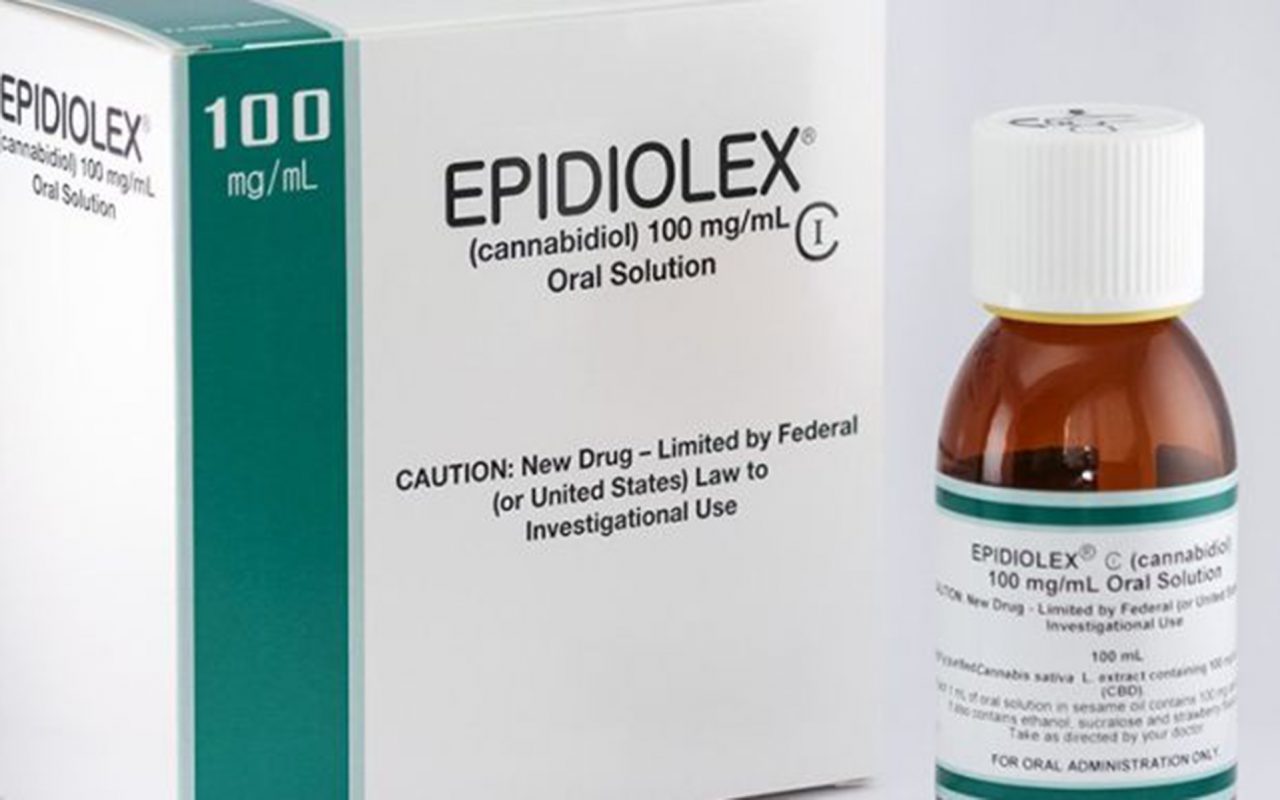
El día de ayer la Administración de Alimentos y Medicamentos (FDA, por su sigla en inglés) de Estados Unidos aprobó el tratamiento para la epilepsia de GW Pharmaceuticals Plc, convirtiéndolo en el primer medicamento sobre la base de cannabis que obtiene su autorización en el país.
El uso de este medicamento es permitido en pacientes de dos o más años con síndrome de Dravet (DS) y síndrome de Lennox-Gastaut (LGS), formas raras de epilepsia que comienzan en la infancia y están entre las más resistentes al tratamiento.
El medicamento, Epidiolex, es elaborado a partir de cannabidiol (CBD), una de las miles de moléculas halladas en la planta de marihuana, y contiene menos de un 0,1 por ciento de tetrahidrocannabinol (THC), el componente psicoactivo que droga a las personas.
GW Pharma cultiva su propia cannabis en invernaderos especializados en Reino Unido para garantizar la uniformidad en la composición genética de las plantas, que luego son procesadas para convertirlas en una solución líquida de CBD.
Como resultado, el lanzamiento de Epidiolex depende de la discreción de la DEA, que ahora debe evaluar el medicamento y considerar si lo reclasifica como una sustancia con propiedades médicas, lo que permitiría que GW inicie su venta.